Diagnostic de macro-matrices ALLERGY XPLORER
Caractéristiques
- Nom du produit : Basic UDI-DI 91201229202JQ
- Numéros de référence : REF 02-2001-01, 02-5001-01
- Utilisation prévue : Détection quantitative des IgE spécifiques aux allergènes (sIgE) et semi-quantitative des IgE totales (tIgE)
- Utilisateurs : Personnel de laboratoire formé et professionnels de la santé dans un laboratoire médical
- Conservation : Les réactifs du kit sont stables 6 mois après ouverture
Instructions d'utilisation du produit
Principe de la procédure
Le produit détecte quantitativement les IgE spécifiques aux allergènes et semi-quantitativement les IgE totales.
Expédition et stockage
Assurez-vous que les réactifs du kit sont stockés comme indiqué et utilisés dans les 6 mois suivant l'ouverture.
Élimination des déchets :
Suivez les procédures d’élimination des déchets appropriées conformément à la réglementation.
Composants du kit
Reportez-vous au manuel d'utilisation pour obtenir des informations détaillées sur les composants du kit.
Équipement requis
Analyse manuelle : Assurez-vous d'avoir l'équipement nécessaire fourni par le fabricant.
Analyse automatique : Utilisez l'appareil MAX, la solution de lavage, la solution d'arrêt, le logiciel d'analyse RAPTOR SERVER et un PC/ordinateur portable. Suivez attentivement les instructions d'entretien.
Gestion des tableaux
Suivez attentivement les instructions fournies pour la manipulation des tableaux afin de garantir des résultats précis.
Avertissements et précautions
- Portez un équipement de protection approprié, comme une protection des mains et des yeux et une blouse de laboratoire.
- Manipuler les réactifs et les samples bonnes pratiques de laboratoire.
- Traitez tous les matériaux d’origine humaine comme potentiellement infectieux et manipulez-les avec précaution.
FAQ
- Q : Combien de temps les réactifs du kit sont-ils stables ?
R : Les réactifs du kit sont stables pendant 6 mois après ouverture lorsqu'ils sont conservés dans les conditions indiquées. - Q : Qui peut utiliser ce produit ?
R : Ce produit est destiné à être utilisé par du personnel de laboratoire qualifié et des professionnels de la santé dans un laboratoire médical.
www.madx.com
MODE D'EMPLOI D'ALLERGY XPLORER (ALEX²)
DESCRIPTION
L'Allergy Xplorer (ALEX²) est un test de diagnostic in vitro basé sur un test immuno-enzymatique (ELISA) pour la mesure quantitative des IgE spécifiques aux allergènes (sIgE).
Cette notice d'utilisation s'applique aux produits suivants :
| UDI-DI de base | RÉF | Produit |
| 91201229202JQ | 02-2001-01 | ALEX² pour 20 analyses |
| 02-5001-01 | ALEX² pour 50 analyses |
OBJECTIF PRÉVU
L'ALEX² Allergy Xplorer est un kit de test utilisé pour l'examen in vitro du sérum ou du plasma humain (à l'exception du plasma EDTA) afin de fournir des informations facilitant le diagnostic des patients souffrant de maladies à médiation IgE en conjonction avec d'autres résultats cliniques ou résultats de tests de diagnostic.
Le dispositif médical IVD détecte les IgE spécifiques des allergènes (sIgE) de manière quantitative et les IgE totales (tIgE) de manière semi-quantitative. Le produit est utilisé par du personnel de laboratoire qualifié et des professionnels de la santé dans un laboratoire médical.
RÉSUMÉ ET EXPLICATION DU TEST
Les réactions allergiques sont des réactions d'hypersensibilité immédiates de type I et sont médiées par des anticorps appartenant à la classe des immunoglobulines IgE. Après exposition à des allergènes spécifiques, la libération d'histamine et d'autres médiateurs par les mastocytes et les basophiles, médiée par les IgE, entraîne des manifestations cliniques telles que l'asthme, la rhino-conjonctivite allergique, l'eczéma atopique et des symptômes gastro-intestinaux [1]. Par conséquent, un schéma de sensibilisation détaillé à des allergènes spécifiques aide à l'évaluation des patients allergiques [2-6]. Il n'y a aucune restriction sur la population testée. Lors de l'élaboration des dosages d'IgE, l'âge et le sexe ne sont généralement pas considérés comme des facteurs critiques car les niveaux d'IgE, qui sont mesurés dans ces dosages, ne varient pas de manière significative en fonction de ces données démographiques.
ALEX² couvre toutes les principales sources d'allergènes de type I. Une liste complète des extraits d'allergènes et des allergènes moléculaires ALEX² se trouve au bas de cette notice.
Informations importantes pour l'utilisateur !
Pour une utilisation correcte d'ALEX², il est nécessaire que l'utilisateur lise et suive attentivement ces instructions d'utilisation. Le fabricant décline toute responsabilité pour toute utilisation de ce système de test qui n'est pas décrite dans ce document ou pour les modifications apportées par l'utilisateur du système de test.
Attention : la variante de kit 02-2001-01 du test ALEX² (20 matrices) est exclusivement destinée au traitement manuel. Pour utiliser cette variante de kit ALEX² avec le MAX 9k automatisé, la solution de lavage (REF 00-5003-01) et la solution d'arrêt (REF 00-5007-01) doivent être commandées séparément. Toutes les informations complémentaires sur le produit se trouvent dans le mode d'emploi correspondant : https://www.madx.com/extras.
La variante du kit ALEX² 02-5001-01 (50 matrices) peut être utilisée pour le traitement automatisé avec l'appareil MAX 9k (REF 17-0000-01) ainsi qu'avec l'appareil MAX 45k (REF 16-0000-01).
PRINCIPE DE LA PROCÉDURE
ALEX² est un test immunologique basé sur la méthode ELISA (Enzyme-Linked Immunosorbent Assay). Des extraits d'allergènes ou des allergènes moléculaires, couplés à des nanoparticules, sont déposés de manière systématique sur une phase solide formant un réseau macroscopique. Tout d'abord, les allergènes liés aux particules réagissent avec des IgE spécifiques présentes dans le sang du patient.ampAprès incubation, les IgE non spécifiques sont éliminées par lavage. La procédure se poursuit par l'ajout d'un anticorps de détection anti-IgE humaine marqué par une enzyme qui forme un complexe avec l'IgE spécifique liée à la particule. Après une deuxième étape de lavage, un substrat est ajouté qui est transformé en un précipité coloré insoluble par l'enzyme liée à l'anticorps. Enfin, la réaction enzyme-substrat est arrêtée par l'ajout d'un réactif de blocage. La quantité de précipité est proportionnelle à la concentration d'IgE spécifique dans le sang du patient.ampLe test en laboratoire est suivi par l'acquisition et l'analyse d'images à l'aide du système manuel (ImageXplorer) ou du système automatisé (MAX 45k ou MAX 9k). Les résultats du test sont analysés avec le logiciel d'analyse RAPTOR SERVER et rapportés en unités de réponse IgE (kUA/l). Les résultats des IgE totales sont également rapportés en unités de réponse IgE (kU/l). RAPTOR SERVER est disponible en version 1. Pour le numéro de version complet à quatre chiffres, veuillez vous référer à l'empreinte RAPTOR SERVER disponible à l'adresse www.raptor-server.com/imprint.
EXPÉDITION ET STOCKAGE
L'expédition d'ALEX² s'effectue à température ambiante. Néanmoins, le kit doit être stocké immédiatement après livraison à 2-8°C. Stockés correctement, ALEX² et ses composants peuvent être utilisés jusqu'à la date de péremption indiquée.
Les réactifs du kit sont stables 6 mois après ouverture (dans les conditions de conservation indiquées).
ÉLIMINATION DES DÉCHETS
Jetez la cartouche ALEX² usagée et les composants du kit non utilisés avec les déchets chimiques de laboratoire. Respectez toutes les réglementations nationales, régionales et locales concernant l'élimination.
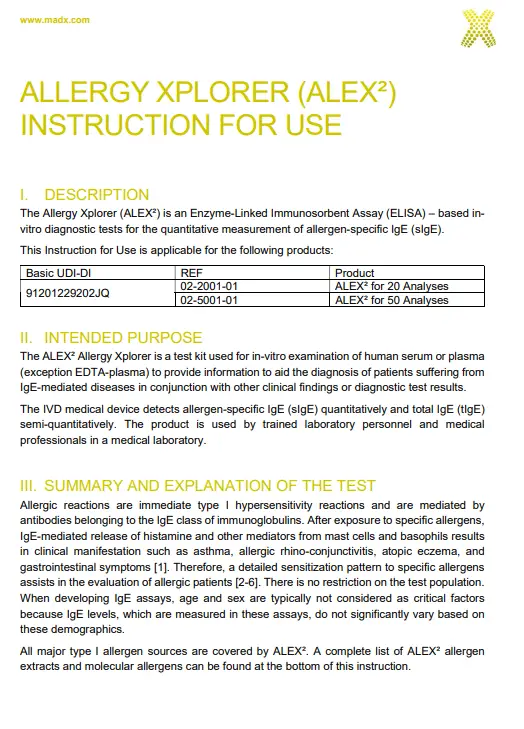
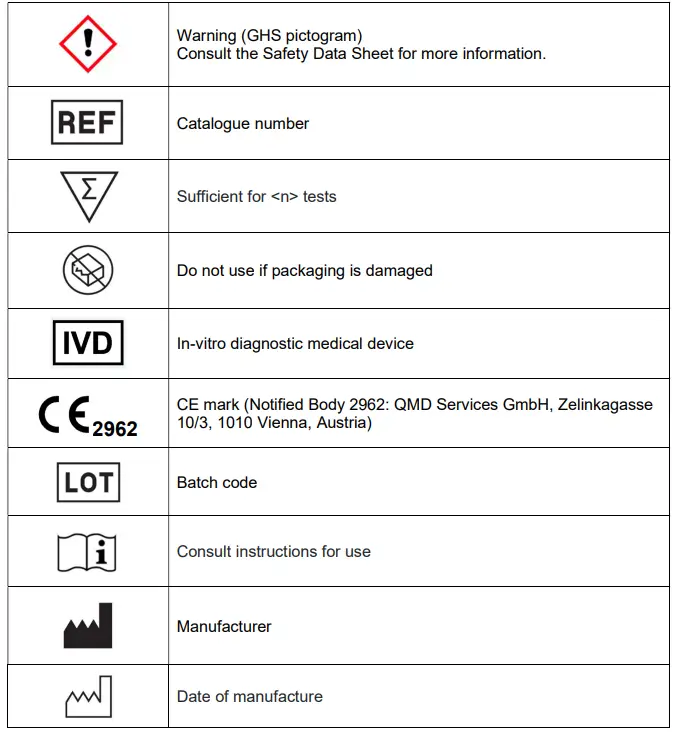
GLOSSAIRE DES SYMBOLES
COMPOSANTS DU KIT
Chaque composant (réactif) est stable jusqu'à la date indiquée sur l'étiquette de chaque composant individuel. Il n'est pas recommandé de regrouper des réactifs provenant de différents lots de kits. Pour obtenir une liste des extraits d'allergènes et des allergènes moléculaires immobilisés sur la matrice ALEX², veuillez contacter support@madx.com.
| Composants du kit REF 02-2001-01 | Contenu | Propriétés |
| Cartouche ALEX² | 2 Blisters de 10 ALEX² pour 20 analyses au total.
Étalonnage via courbe maîtresse disponible via RAPTOR SERVER Logiciel d'analyse. |
Prêt à l'emploi. A conserver entre 2 et 8°C jusqu'à la date de péremption. |
| ALEX² Sample Diluant | 1 flacon de 9 ml | Prêt à l'emploi. Conserver entre 2 et 8°C jusqu'à la date de péremption. Laisser le réactif atteindre la température ambiante avant utilisation. Le réactif ouvert est stable pendant 6 mois à 2-8°C, contient un inhibiteur CCD. |
| Solution de lavage | 2 flacon de 50 ml | Prêt à l'emploi. Conserver à 2-8°C jusqu'à la date de péremption. Laisser le réactif atteindre la température ambiante avant utilisation. Le réactif ouvert est stable pendant 6 mois à 2-8°C. |
| Composants du kit REF 02-2001-01 | Contenu | Propriétés |
| Anticorps de détection ALEX² | 1 flacon de 11 ml | Prêt à l'emploi. Conserver à 2-8°C jusqu'à la date de péremption. Laisser le réactif atteindre la température ambiante avant utilisation. Le réactif ouvert est stable pendant 6 mois à 2-8°C. |
| Solution de substrat ALEX² | 1 flacon de 11 ml | Prêt à l'emploi. Conserver à 2-8°C jusqu'à la date de péremption. Laisser le réactif atteindre la température ambiante avant utilisation. Le réactif ouvert est stable pendant 6 mois à 2-8°C. |
| (ALEX²) Solution d'arrêt | 1 flacon de 2.4 ml | Prêt à l'emploi. Conserver entre 2 et 8 °C jusqu'à la date de péremption. Laisser le réactif atteindre la température ambiante avant utilisation. Le réactif ouvert est stable pendant 6 mois à 2-8 °C. Peut apparaître comme une solution trouble après un stockage prolongé. Cela n'a aucun effet sur les résultats. |
| Composants du kit REF 02-5001-01 | Contenu | Propriétés |
| Cartouche ALEX² | 5 Blisters de 10 ALEX² pour 50 analyses au total.
Étalonnage via courbe principale disponible via le logiciel d'analyse RAPTOR SERVER. |
Prêt à l'emploi. A conserver entre 2 et 8°C jusqu'à la date de péremption. |
| ALEX² Sample Diluant | 1 flacon de 30 ml | Prêt à l'emploi. Conserver entre 2 et 8°C jusqu'à la date de péremption. Laisser le réactif atteindre la température ambiante avant utilisation. Le réactif ouvert est stable pendant 6 mois à 2-8°C, contient un inhibiteur CCD. |
| Solution de lavage | 4 x conc. 1 flacon de 250 ml | Conserver entre 2 et 8°C jusqu'à la date de péremption. Diluer 1 à 4 avec de l'eau déminéralisée avant utilisation. Laisser le réactif atteindre la température ambiante avant utilisation. Le réactif ouvert est stable 6 mois à 2-8°C. |
| Anticorps de détection ALEX² | 1 flacon de 30 ml | Prêt à l'emploi. Conserver à 2-8°C jusqu'à la date de péremption. Laisser le réactif atteindre la température ambiante avant utilisation. Le réactif ouvert est stable pendant 6 mois à 2-8°C. |
| Composants du kit REF 02-5001-01 | Contenu | Propriétés |
| Solution de substrat ALEX² | 1 flacon de 30 ml | Prêt à l'emploi. Conserver entre 2 et 8°C jusqu'à la date de péremption. Laisser le réactif atteindre la température ambiante avant utilisation. Le réactif ouvert est
stable 6 mois à 2-8°C. |
| (ALEX²) Solution d'arrêt | 1 flacon de 10 ml | Prêt à l'emploi. Conserver entre 2 et 8 °C jusqu'à la date de péremption. Laisser le réactif atteindre la température ambiante avant utilisation. Le réactif ouvert est stable pendant 6 mois à 2-8 °C. Peut apparaître comme une solution trouble après un stockage prolongé. Cela n'a aucun effet sur les résultats. |
ÉQUIPEMENT REQUIS POUR LE TRAITEMENT ET L'ANALYSE
Analyse manuelle
- ImageXplorer
- Arrayholder (optionnel)
- Lab Rocker (angle d'inclinaison 8°, vitesse requise 8 tr/min)
- Chambre d'incubation (LxPxH – 35x25x2 cm)
- Logiciel d'analyse RAPTOR SERVER
- PC/Ordinateur portable
Matériel nécessaire, non fourni par MADx :
- Eau déminéralisée
- Pipettes et pointes (100 µl et 100 – 1000 µl)
Analyse automatique :
- Appareil MAX (MAX 45k ou MAX 9k)
- Solution de lavage (REF 00-5003-01)
- Solution d'arrêt (REF 00-5007-01)
- Logiciel d'analyse RAPTOR SERVER
- PC/Ordinateur portable
Services d'entretien selon les instructions du fabricant.
MANIPULATION DES TABLEAUX
Ne touchez pas la surface de la matrice. Tout défaut de surface causé par des objets contondants ou tranchants peut interférer avec la lecture correcte des résultats. N'acquérez pas d'images ALEX² avant que la matrice ne soit complètement sèche (séchage à température ambiante).
AVERTISSEMENTS ET PRÉCAUTIONS
- Il est recommandé de porter une protection des mains et des yeux ainsi que des blouses de laboratoire et de suivre les bonnes pratiques de laboratoire lors de la préparation et de la manipulation des réactifs et des samples.
- Conformément aux bonnes pratiques de laboratoire, tout matériel d'origine humaine doit être considéré comme potentiellement infectieux et manipulé avec les mêmes précautions que celles du patient.amples.
- ALEX² SampLe diluant et la solution de lavage contiennent de l'azoture de sodium (< 0.1 %) comme conservateur et doivent être manipulés avec précaution. La fiche de données de sécurité est disponible sur demande.
- La solution d'arrêt (ALEX²) contient une solution d'acide éthylènediaminetétraacétique (EDTA) et doit être manipulée avec précaution. La fiche de données de sécurité est disponible sur demande.
- Pour usage diagnostique in vitro uniquement. Ne pas utiliser en usage interne ou externe chez l'homme ou l'animal.
- Seul le personnel formé aux pratiques de laboratoire doit utiliser ce kit.
- À l'arrivée, vérifiez que les composants du kit ne sont pas endommagés. Si l'un des composants est endommagé (par exemple, les bouteilles tampons), contactez MADx (support@madx.com) ou votre distributeur local. N'utilisez pas de composants de kit endommagés, car leur utilisation peut entraîner une mauvaise performance du kit.
- Ne pas utiliser les réactifs au-delà de leur date de péremption.
- Ne mélangez pas les réactifs de différents lots.
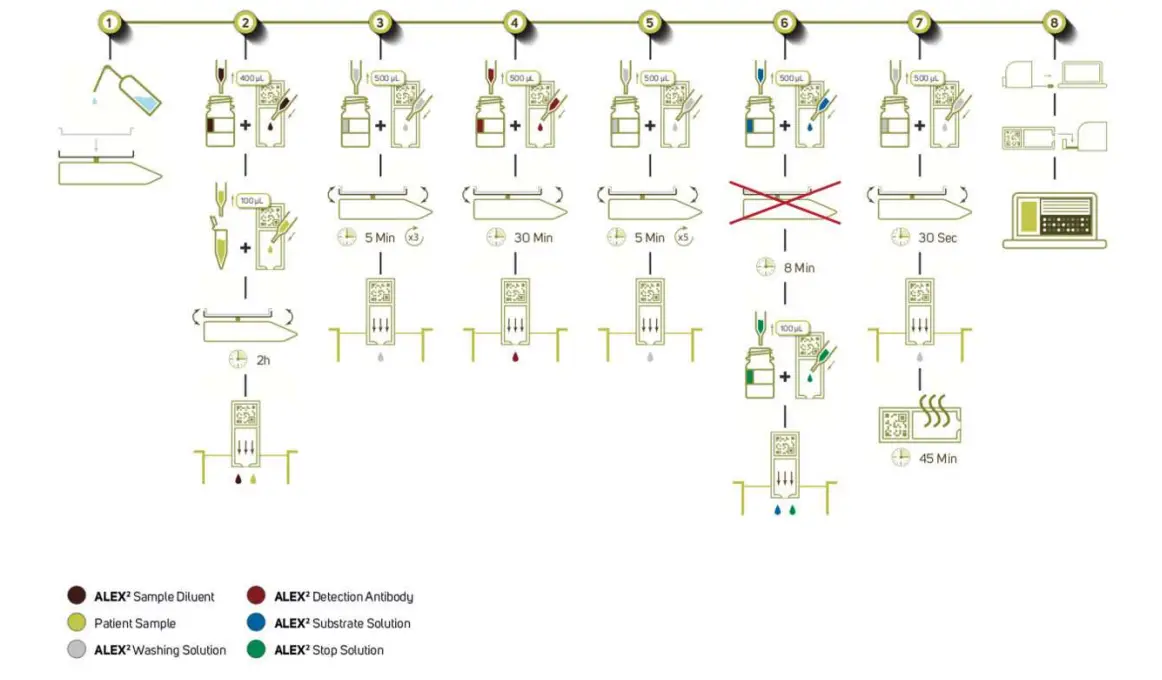
PROCÉDURE ELISA
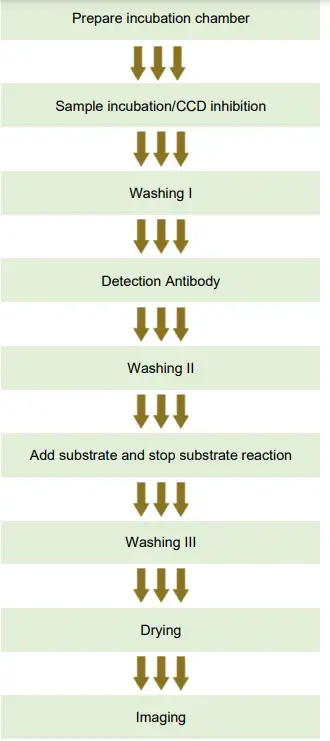
Préparation
Préparation de samples : Sérum ou plasma (héparine, citrate, sans EDTA)ampDes échantillons de sang capillaire ou veineux peuvent être utilisés. Du sangampLes fichiers peuvent être collectés en utilisant des procédures standard. Magasinsampà 2–8°C pendant une semaine maximum. Conserver le sérum et le plasmaampà -20°C pour un stockage prolongé. Expédition de sérum/plasma samples à température ambiante est applicable. Toujours autoriser samples amener à température ambiante avant utilisation.
Préparation de la solution de lavage (uniquement pour REF 02-5001-01 et REF 00-5003-01 en cas d'utilisation avec l'appareil MAX) : Verser le contenu d'un flacon de solution de lavage dans le récipient de lavage de l'instrument. Remplir d'eau déminéralisée jusqu'au repère rouge et mélanger soigneusement le récipient plusieurs fois sans générer de mousse. Le réactif ouvert est stable 1 mois à 6-2°C.
Chambre d'incubation : Fermez le couvercle pour toutes les étapes du test afin d'éviter une baisse d'humidité.
Paramètres of Procédure:
- 100 µl-sample + 400 µl ALEX² Sample Diluant
- 500 µl d'anticorps de détection ALEX²
- 500 µl de solution de substrat ALEX²
- 100 µl (ALEX²) Solution d'arrêt
- Solution de lavage 4500 µl
La durée de l'analyse est d'environ 3 h 30 min (sans séchage de la matrice traitée).
Il n'est pas recommandé d'effectuer plus d'essais que ce qui peut être pipeté en 8 minutes. Toutes les incubations sont réalisées à température ambiante, 20-26°C.
Tous les réactifs doivent être utilisés à température ambiante (20-26°C). Le test ne doit pas être effectué en plein soleil.
Préparer la chambre d'incubation
Ouvrez la chambre d'incubation et placez des serviettes en papier sur la partie inférieure. Trempez les serviettes en papier dans de l'eau déminéralisée jusqu'à ce qu'aucune partie sèche des serviettes en papier ne soit visible.
Sampl'incubation/inhibition CCD
Retirez le nombre nécessaire de cartouches ALEX² et placez-les dans le(s) support(s) de matrice. Ajoutez 400 μl d'ALEX² Sample diluant dans chaque cartouche. Ajouter 100 μl de solution patientampVerser le sérum dans les cartouches. Veiller à ce que la solution obtenue soit répartie uniformément. Placer les cartouches dans la chambre d'incubation préparée et placer la chambre d'incubation avec les cartouches sur le Lab Rocker de manière à ce que les cartouches basculent le long du côté long de la cartouche. Démarrer l'incubation du sérum à 8 tr/min pendant 2 heures. Fermer la chambre d'incubation avant de démarrer le Lab Rocker. Après 2 heures, décharger le sérumampfichiers dans un conteneur de collecte. Essuyez soigneusement les gouttelettes de la cartouche à l'aide d'une serviette en papier.
Évitez de toucher la surface du tableau avec l'essuie-tout ! Évitez tout transfert ou contamination croisée des samples entre les cartouches ALEX² individuelles !
Hom s LF optionnel ou positif (marqueur CCD) : avec le protocole standard d'inhibition des anticorps CCD (comme décrit au paragraphe 2 : samp(incubation/inhibition CCD) l'efficacité d'inhibition CCD est de 85 %. Si un taux d'efficacité d'inhibition plus élevé est requis, préparez une solution de 1 mlample tube, ajouter 400 μl d'ALEX² Sample diluant et 100 μl de sérum. Incuber pendant 30 minutes (sans agitation) puis procéder à la procédure de dosage habituelle.
Note: L'étape supplémentaire d'inhibition du CCD conduit dans de nombreux cas à un taux d'inhibition des anticorps CCD supérieur à 95 %.
1a. Laver je
Ajoutez 500 µl de solution de lavage à chaque cartouche et laissez incuber sur le agitateur de laboratoire (à 8 tr/min) pendant 5 minutes. Videz la solution de lavage dans un récipient de collecte et tapotez vigoureusement les cartouches sur une pile de serviettes en papier sèches. Essuyez soigneusement les gouttelettes restantes des cartouches à l'aide d'une serviette en papier.
Répétez cette étape 2 fois de plus.
Ajouter un anticorps de détection
Ajoutez 500 µl d’anticorps de détection ALEX² à chaque cartouche.
Assurez-vous que la surface complète du réseau est recouverte par la solution d'anticorps de détection ALEX².
Placez les cartouches dans la chambre d'incubation sur le balanceur de laboratoire et laissez incuber à 8 tr/min pendant 30 minutes. Videz la solution d'anticorps de détection dans un récipient de collecte et tapotez vigoureusement les cartouches sur une pile de serviettes en papier sèches. Essuyez soigneusement les gouttelettes restantes des cartouches à l'aide d'une serviette en papier.
2a. Lavage II
Ajoutez 500 μl de solution de lavage à chaque cartouche et laissez incuber sur le agitateur de laboratoire à 8 tr/min pendant 5 minutes. Videz la solution de lavage dans un récipient de collecte et tapotez vigoureusement les cartouches sur une pile de serviettes en papier sèches. Essuyez soigneusement les gouttelettes restantes des cartouches à l'aide d'une serviette en papier.
Répétez cette étape 4 fois de plus.
3+4. Ajoutez la solution de substrat ALEX² et arrêtez la réaction du substrat
Ajoutez 500 μl de solution de substrat ALEX² à chaque cartouche. Démarrez un chronomètre en remplissant la première cartouche et continuez avec le remplissage des cartouches restantes. Assurez-vous que la surface complète de la matrice est recouverte par la solution de substrat et incubez les matrices pendant exactement 8 minutes sans agitation (balancelle de laboratoire à 0 tr/min et en position horizontale).
Après exactement 8 minutes, ajoutez 100 μl de la solution d'arrêt (ALEX²) à toutes les cartouches, en commençant par la première cartouche pour garantir que toutes les matrices sont incubées pendant la même durée avec la solution de substrat ALEX². Agiter soigneusement pour répartir uniformément la solution d'arrêt (ALEX²) dans les cartouches de matrice, après que la solution d'arrêt (ALEX²) a été pipetée sur toutes les matrices. Videz ensuite la solution de substrat/d'arrêt (ALEX²) des cartouches et tapotez vigoureusement les cartouches sur une pile de serviettes en papier sèches. Essuyez soigneusement les gouttelettes restantes des cartouches à l'aide d'une serviette en papier.
Le Lab Rocker ne doit PAS SECOUER pendant l'incubation du substrat !
4a. Lavage III
Ajoutez 500 μl de solution de lavage à chaque cartouche et laissez incuber sur le agitateur de laboratoire à 8 tr/min pendant 30 secondes. Videz la solution de lavage dans un récipient de collecte et tapotez vigoureusement les cartouches sur une pile de serviettes en papier sèches. Essuyez soigneusement les gouttelettes restantes des cartouches à l'aide d'une serviette en papier.
Analyse d'images
Une fois la procédure d’analyse terminée, séchez les matrices à l’air libre à température ambiante jusqu’à ce qu’elles soient complètement sèches (cela peut prendre jusqu’à 45 minutes).
Le séchage complet est essentiel pour la sensibilité du test. Seuls les réseaux complètement séchés offrent un rapport signal/bruit optimal.
Enfin, les matrices séchées sont numérisées avec l'instrument ImageXplorer ou un appareil MAX et analysées avec le logiciel d'analyse RAPTOR SERVER (voir les détails dans le manuel du logiciel RAPTOR SERVER). Le logiciel d'analyse RAPTOR SERVER n'est vérifié qu'en combinaison avec l'instrument ImageXplorer et les appareils MAX, par conséquent MADx n'assume aucune responsabilité pour les résultats obtenus avec tout autre appareil de capture d'images (comme les scanners).
Étalonnage du dosage
La courbe d'étalonnage principale ALEX² a été établie par des tests de référence sur des préparations de sérum avec des IgE spécifiques contre différents antigènes couvrant la plage de mesure prévue. Les paramètres d'étalonnage spécifiques au lot sont fournis par le logiciel d'analyse RAPTOR SERVER. Les résultats du test ALEX² sIgE sont exprimés en kUA/l. Les résultats des IgE totales sont semi-quantitatifs et calculés à partir d'une mesure anti-IgE avec des facteurs d'étalonnage spécifiques au lot, qui sont fournis par le logiciel d'analyse RAPTOR SERVER et sélectionnés en fonction des codes QR spécifiques au lot.
Les paramètres de la courbe de chaque lot sont ajustés par un système de test de référence interne, par rapport aux préparations de sérum testées sur ImmunoCAP (Thermo Fisher Scientific) pour les IgE spécifiques contre plusieurs allergènes. Les résultats d'ALEX² sont donc indirectement traçables par rapport à la préparation de référence de l'OMS 11/234 pour les IgE totales.
Les variations systématiques des niveaux de signal entre les lots sont normalisées par étalonnage hétérologue par rapport à une courbe de référence IgE. Un facteur de correction est utilisé pour ajuster systématiquement les écarts de mesure spécifiques au lot.
Plage de mesure
IgE spécifique : 0.3-50 kUA/l quantitative
IgE totales : 20-2500 kU/l semi-quantitatif
CONTRÔLE DE QUALITÉ
Enregistrement de chaque essai
Conformément aux bonnes pratiques de laboratoire, il est recommandé d’enregistrer les numéros de lot de tous les réactifs utilisés.
Spécimens de contrôle
Selon les bonnes pratiques de laboratoire, il est recommandé que le contrôle de la qualité sampLes valeurs de référence pour certains sérums de contrôle disponibles dans le commerce peuvent être fournies par MADx sur demande.
ANALYSE DES DONNÉES
Pour l'analyse d'images des matrices traitées, il faut utiliser l'ImageXplorer ou un appareil MAX. Les images ALEX² sont automatiquement analysées à l'aide du logiciel d'analyse RAPTOR SERVER et un rapport résumant les résultats est généré pour l'utilisateur.
RÉSULTATS
ALEX² est un test ELISA quantitatif pour les IgE spécifiques et une méthode semi-quantitative pour les IgE totales. Les anticorps IgE spécifiques aux allergènes sont exprimés en unités de réponse IgE (kUA/l), les résultats des IgE totales en kU/l. Le logiciel d'analyse RAPTOR SERVER calcule et rapporte automatiquement les résultats des IgE spécifiques (quantitatifs) et des IgE totales (semi-quantitatifs).
LIMITES DE LA PROCÉDURE
Un diagnostic clinique définitif ne doit être établi qu’en conjonction avec tous les résultats cliniques disponibles auprès des professionnels de la santé et ne doit pas être basé sur les résultats d’une seule méthode de diagnostic.
Dans certains domaines d'application (par exemple l'allergie alimentaire), les anticorps IgE circulants peuvent rester indétectables bien qu'une manifestation clinique d'allergie alimentaire contre un certain allergène puisse être présente, car ces anticorps peuvent être spécifiques aux allergènes qui sont modifiés lors du traitement industriel, de la cuisson ou de la digestion et n'existent donc pas sur l'aliment d'origine pour lequel le patient est testé.
Les résultats négatifs au venin indiquent uniquement des niveaux indétectables d'anticorps IgE spécifiques au venin (par exemple en raison d'une non-exposition à long terme) et n'excluent pas l'existence d'une hypersensibilité clinique aux piqûres d'insectes.
Chez les enfants, en particulier jusqu'à l'âge de 2 ans, la plage normale de tIgE est inférieure à celle des adolescents et des adultes [7]. Il faut donc s'attendre à ce que chez une proportion plus élevée d'enfants de moins de 2 ans, le taux total d'IgE soit inférieur à la limite de détection spécifiée. Cette limitation ne s'applique pas à la mesure des IgE spécifiques.
VALEURS ATTENDUES
L'association étroite entre les niveaux d'anticorps IgE spécifiques aux allergènes et les maladies allergiques est bien connue et est décrite en détail dans la littérature [1]. Chaque patient sensibilisé présentera une protéine IgE individuellefile lorsqu'il est testé avec ALEX². La réponse IgE avec sampLes concentrations d'IgE totales chez les sujets sains non allergiques seront inférieures à 0.3 kUA/l pour les allergènes moléculaires simples et pour les extraits d'allergènes lorsqu'elles sont testées avec ALEX². La zone de référence pour les IgE totales chez les adultes est < 100 kU/l. Les bonnes pratiques de laboratoire recommandent que chaque laboratoire établisse sa propre plage de valeurs attendues.
CARACTÉRISTIQUES DE PERFORMANCE
Les caractéristiques de performance ainsi que le résumé des caractéristiques de sécurité et de performance sont disponibles sur le MADx website: https://www.madx.com/extras.
GARANTIE
Les données de performance ont été obtenues en suivant la procédure décrite dans ce mode d'emploi. Tout changement ou modification de la procédure peut affecter les résultats et MacroArray Diagnostics décline toute garantie expresse (y compris la garantie implicite de qualité marchande et d'adéquation à l'emploi) dans un tel cas. Par conséquent, MacroArray Diagnostics et ses distributeurs locaux ne seront pas responsables des dommages indirects ou consécutifs dans un tel cas.
ABRÉVIATIONS
| ALEX | Explorateur d'allergies |
| CCD | Déterminants glucidiques à réactivité croisée |
| EDTA | Acide éthylènediaminetétraacétique |
| ELISA | Dosage immuno-enzymatique |
| IgE | Immunoglobuline E |
| IVD | Diagnostic in vitro |
| kU/l | Unités kilo par litre |
| kUA/l | Kilo-unités d'IgE spécifiques aux allergènes par litre |
| MADx | Diagnostics de macroréseau |
| RÉF | Numéro de référence |
| tr/min | Tours par minute |
| sIGe | IgE spécifique des allergènes |
| tIgE | IgE totales |
| µl | Microlitre |
LISTE DES ALLERGÈNES ALEX²
Extraits d'allergènes: Aca m, Aca s, Ach d, Ail a, All c, All s, Amar, Amb a, Ana o, Api m, Art v, Ave s, Ber e, Bos d viande, Bos d lait, Bro p, Cam d, Can f ♂ urine, Can s, Cap a, Cap h épithélium, Cap h lait, Car c, Car i, Car p, Che a, Che q, Chi spp., Cic a, Cit s, Cla h, Clu h, Cor a pollen, Cuc p, Cup s, Cyn d, Dau c, Dol spp., Equ c lait, Equ c viande, Fag e, Fic b, Fic c, Fra e, Gad m, Gal d viande, Gal d blanc, Gal d jaune, Hel a, Hom g, Hor v, Jug r, Jun a, Len c, Lit s, Loc m, Lol spp., Lup a, Mac i, Man i, Mel g, Mor r, Mus a, Myte, Oriv, viande d'Ory, Ory s, Ost e, épithélium d'Ovi a, viande d'Ovi a, lait d'Ovi a, Pan b, Pan m, Pap s, Par j, Pas n, Pec spp., Pen ch, Per a, Pers a, Pet c, Pha v, Phr c, Pima, Pis s, Pla l, Pol d, Pop n, Pru av, Pru du, Pyr c, Raj c, Rat n, Rud spp., Sac c, Sal k, Sal s, Sco s, farine Sec c, pollen Sec c, Ses i, Sin, Sol spp., Sola l, Sol t, épithélium Sus d, viande Sus d, Ten m, Thu a, Tri fo, Tri s, Tyr p, Ulm c, Urt d, Vac m, Ves v, farine Zea m
Composants naturels purifiés : nAct d 1, nApi m 1, nAra h 1, nAra h 3, nBos d 4, nBos d 5, nBos d 6, nBos d 8, nCan f 3, nCor a 9, nCor a 11, nCup a 1, nCry j 1, nEqu c 3, nFag e 2, nGad m 1, nGad m 2 + 3, nGal d 2, nGal d 3, nGal d 4, nGal d 5, nGly m 5, nGly m 6, nJug r 4, nMac i Albumine 2S, nOle e 7 (RUO), nPap s Albumine 2S, nPis v 3, nPla a 2, nTri a aA_TI
Composants recombinants : rAct d 10, rAct d 2, rAct d 5, rAln g 1, rAln g 4, rAlt a 1, rAlt a 6, ramb a 1, ramb a 4, rAna o 2, rAna o 3, rAni s 1, rAni s 3, rapi g 1, rapi g 2, rapi g 6, rapi m 10, rAra h 2, rAra h 6, rAra h 8, rAra h 9, rAra h 15, rArg r 1, rArt v 1, rArt v 3, rAsp f 1, rAsp f 3, rAsp f 4, rAsp f 6, rBer e 1, rBet contre 1, rBet contre 2, rBet contre 6, rBla g 1, rBla g 2, rBla g 4, rBla g 5, rBla g 9, rBlo t 10, rBlo t 21, rBlo t 5, rBos d 2, rCan f 1, rCan f 2, rCan f 4, rCan f 6, rCan f Fel d 1 comme, rCan s 3, rCav p 1, rChe a 1, rCla h 8, rClu h 1, rCor a 1.0103, rCor a 1.0401 , rCor a 8, rCor a 12 (RUO), rCor a 14, rCra c 6, , rCuc m 2, rCyn d 1, rCyp c 1, rDau c 1, rDer f 1, rDer f 2, rDer p 1, rDer p 10, rDer p 11, rDer p 2, rDer p 20, rDer p 21, rDer p 23, rDer p 5, rDer p 7, rEqu c 1, rEqu c 4, rFag s 1, rFel d 1, rFel d 2, rFel d 4, rFel d 7, rFra a 1 + 3, rFra e 1, rGal d 1, rGly d 2, rGly m 4, rGly m 8, rHev b 1, rHev b 3, rHev b 5, rHev b 6.02, rHev b 8, rHev b 11, rHom s LF, rJug r 1, rJug r 2, rJug r 3, rJug r 6, rLep d 2, rLol p 1, rMal d 1, rMal d 3, rMala s 11, rMala s 5, rMala s 6, rMal d 2, rMer a 1, rMes a 1 (RUO), rMus m 1, rôle e 1, rôle e 9, rOry c 1, rOry c 2, rOry c 3, rPar j 2, rPen m 1, rPen m 2, rPen m 3, rPen m 4, rPer a 7, rPhl p 1, rPhl p 12, rPhl p 2, rPhl p 5.0101, rPhl p 6, rPhl p 7, rPho d 2, rPhod s 1, rPis v 1, rPis v 2, rPis v 4 (RUO), rPla a 1, rPla a 3, rPla l 1, rPol d 5, rPru p 3, rPru p 7 (RUO), rRaj c Parvalbumine, rSal k 1, rSal s 1, rSco s 1, rSes i 1, rSin a 1, rSola l 6, rSus d 1, rThu a 1, rTri a 14, rTri a 19, rTyr p 2, rVes v 1, rVes v 5, rVit v 1, rXip g 1, rZea m 14
RÉFÉRENCES
- Hamilton, RG. (2008). Évaluation des maladies allergiques humaines. Immunologie clinique. 1471-1484. 10.1016/B978-0-323-04404-2.10100-9.
- Harwanegg C, Laffer S, Hiller R, Mueller MW, Kraft D, Spitzauer S, Valenta R. Allergènes recombinants microarrayés pour le diagnostic de l'allergie. Clin Exp Allergy. 2003 Jan;33(1):7-13. doi: 10.1046/j.1365-2222.2003.01550.x. PMID: 12534543.
- Hiller R, Laffer S, Harwanegg C, Huber M, Schmidt WM, Twardosz A, Barletta B, Becker WM, Blaser K, Breiteneder H, Chapman M, Crameri R, Duchêne M, Ferreira F, Fiebig H, Hoffmann-Sommergruber K, King TP, Kleber-Janke T, Kurup VP, Lehrer SB, Lidholm J, Müller U, Pini C, Reese G, Scheiner O, Scheynius A, Shen HD, Spitzauer S, Suck R, Swoboda I, Thomas W, Tinghino R, Van Hage-Hamsten M, Virtanen T, Kraft D, Müller MW, Valenta R. Molécules allergènes microarrayées : gardiens de diagnostic pour le traitement des allergies. FASEB J. 2002 mars; 16(3):414-6. doi: 10.1096/fj.01-0711fje. Publication électronique du 2002 janvier 14. PMID: 11790727
- Ferrer M, Sanz ML, Sastre J, Bartra J, del Cuvillo A, Montoro J, Jáuregui I, Dávila I, Mullol J, Valero A. Diagnostic moléculaire en allergologie : application de la technique des microarrays. J Investig Allergol Clin Immunol. 2009;19 Suppl 1:19-24. PMID: 19476050.
- Ott H, Fölster-Holst R, Merk HF, Baron JM. Microarrays d'allergènes : un nouvel outil pour le profilage IgE à haute résolution chez les adultes atteints de dermatite atopique. Eur J Dermatol. 2010 janv.-févr.;20(1):54-
61. est ce que je : 10.1684/ejd.2010.0810. Publication en ligne du 2009 octobre 2. PMID : 19801343. - Sastre J. Diagnostic moléculaire en allergie. Clin Exp Allergy. 2010 Oct;40(10):1442-60. doi: 10.1111/j.1365-2222.2010.03585.x. Epub 2010 Aug 2. PMID: 20682003.
- Martins TB, Bandhauer ME, Bunker AM, Roberts WL, Hill HR. Nouveaux intervalles de référence pour l'enfance et l'âge adulte pour les IgE totales. J Allergy Clin Immunol. 2014 févr.;133(2):589-91.
Pour plus de détails sur les études analytiques et cliniques réalisées, reportez-vous aux caractéristiques de performance à l'adresse https://www.madx.com/extras.
CHANGEMENT D'HISTORIQUE
| Version | Description | Remplace |
| 11 | nGal d1 changé en rGal d1 ; URL mis à jour à madx.com; CE complété par le numéro de l'organisme notifié ; historique des modifications ajouté | 10 |

© Copyright par MacroArray Diagnostics
Diagnostics de macroréseaux (MADx)
Lemböckgasse 59, Top 4
1230 Vienne, Autriche
+43 (0)1 865 2573
www.madx.com
Numéro de version : 02-IFU-01-FR-11 Sortie : 09-2024
Guide rapide
Diagnostics de macroréseau
Lemböckgasse 59, Top 4
1230 Vienne
madx.com
CRN448974g
Documents / Ressources
 |
Diagnostic de macro-matrices ALLERGY XPLORER [pdf] Instructions 91201229202JQ, 02-2001-01, 02-5001-01, Diagnostics de matrice de macro ALLERGY XPLORER, ALLERGY XPLORER, Diagnostics de matrice de macro, Diagnostics de matrice, Diagnostics |




